Exufiber dans la pratique
L'état de la peau périlésionnelle s'est amélioré et la taille des ulcères du pied diabétiques a diminué lors d'une étude sur 21 patients traités par Exufiber®.
Étude post clinique ouverte, non comparative, multicentrique des performances et de l'innocuité d'un pansement pour plaies à base de fibres gélifiantes sur des ulcères du pied diabétiques
Chadwick, P., McCardle, J. Journal of Wound Care 2016; 25(4):290-300.
- L'ulcération du pied chez les patients diabétiques est difficile à traiter.
- Les patients dont le diabète est mal traité présentent un risque accru d'ulcération et d'amputation du pied.
- Le choix du pansement est un aspect important du traitement de l'ulcère du pied diabétique (UPD).
- Les UPD sont associés à des coûts médicaux mais aussi personnels, sociaux et économiques.
- Comme d'autres plaies chroniques, les UPD peuvent produire des quantités importantes d'exsudats. De ce fait, la peau périlésionnelle est exposée à un risque de macération.
Objectifs
Évaluer les performances et l'innocuité d'Exufiber, un pansement pour plaies à base de fibres gélifiantes dans le traitement des UPD.
Méthodes
- Il s'agit d'une étude ouverte, non comparative et multicentrique.
- Les patients hospitalisés et en consultation externe étaient éligibles.
Objectif principal de l'étude :
- Évaluer les performances et l'innocuité d'Exufiber utilisé tel que recommandé sur des UPD.
- Conformément à cet objectif, plusieurs paramètres d'évaluation ont été mesurés pour surveiller l'état de la peau périlésionnelle (évaluation en termes d'évolution par rapport aux évaluations de départ) : macération, rougeur / irritations, éruption cutanée / eczéma, vésication, dermatite, décollement de la peau, lésions sur les bords de la plaie, dégradation du produit sur la peau.
Objectif secondaire de l'étude :
- Évaluation de la douleur liée au pansement (mesurée à l'aide d'une échelle visuelle analogue (EVA) de 100 mm).
- État de la plaie (mesuré en fonction des évolutions de la taille de la plaie et de la phase de cicatrisation).
- Opinions du clinicien / du patient sur le produit à l'essai.
- Performances techniques du produit à l'essai (mesurées par la présence de résidus de pansement suite au retrait, et gestion des exsudats de la plaie).
- Les patients présentant plus d'un ulcère étaient éligibles à l'investigation. Cependant, seul un ulcère par patient a été inclus à l'investigation.
- Chaque patient a été traité conformément à la routine clinique locale et tous les pansements ont été appliqués en respectant les instructions du fabricant.
- Les patients ont participé à l'investigation jusqu'à la cicatrisation complète de la plaie ou l'assèchement de la plaie traitée (cas dans lequel le produit à l'essai n'était plus applicable), ou pendant 12 semaines, selon la première des éventualités.
- Les patients ont été examinés au début de l'étude puis en semaines 1, 2, 4, 6, 8 et 12 après le traitement.
- Les changements de pansements ont été effectués selon la routine clinique locale (généralement 3 fois par semaine) lorsque le pansement était saturé et selon l'état et la localisation de la plaie ; les changements de pansements entre les visites étaient autorisés.
- À chaque visite de contrôle, les variables suivantes ont été évaluées :
- Taille de la plaie, volume (utilisation du programme Pictzat) et profondeur au point le plus profond de la plaie (à l'aide d'un coton-tige) ; les mesures ont été réalisées toutes les quatre semaines et une mesure supplémentaire a été réalisée en semaine 6)
- Aspect du lit de la plaie
- État de la peau périlésionnelle
- Performances techniques
- Quantité et type d'exsudat
- Nécessité d'un débridement
- Événements indésirables (EI) / Effets indésirables liés au dispositif (EID)
- Douleur (avant le retrait du pansement secondaire, avant le retrait du produit à l'essai, pendant le retrait du produit à l'essai, après le retrait du produit à l'essai). Certains patients n'ont pas été éligibles à l'évaluation de la douleur en raison d'une neuropathie
- Signes cliniques d'infection
Résultats
- 21 patients ont été inclus à l'investigation, rattachés à deux centres.
- Tous les patients recrutés (éligibles au traitement avec le produit à l'essai) étaient des hommes de type caucasien atteints d'un UPD actif ; les patients étaient âgés en moyenne de 59,9 ans.
État de la peau périlésionnelle
- Le nombre de patients présentant une peau périlésionnelle saine / intacte a augmenté, passant de 6 patients (28,6%) au début de l'étude à 14 patients (66,7%) à la dernière visite.
- Le pourcentage de patients associés à un signe spécifique d'état insatisfaisant de la peau périlésionnelle a chuté ou s'est maintenu à zéro pour la majorité des signes, de la visite de départ à la visite finale.
- Aucune occurrence de dégradation du produit sur la peau n'a été observée.
Exsudat de la plaie
- Une diminution régulière du volume d'exsudat de la plaie tout au long de la période d'étude a été observée ; le pourcentage de patients sans exsudat a augmenté, passant de 0% au début de l'étude à 33,3% en semaine 12.
- L'exsudat était principalement séreux tout au long de la période d'étude.
Douleur
- Les niveaux de douleur observés ont été bas tout au long de la période d'étude (certains patients n'étaient pas éligibles à l'évaluation de la douleur en raison d'une neuropathie ou de la cicatrisation effective de l'ulcère).
État de la plaie
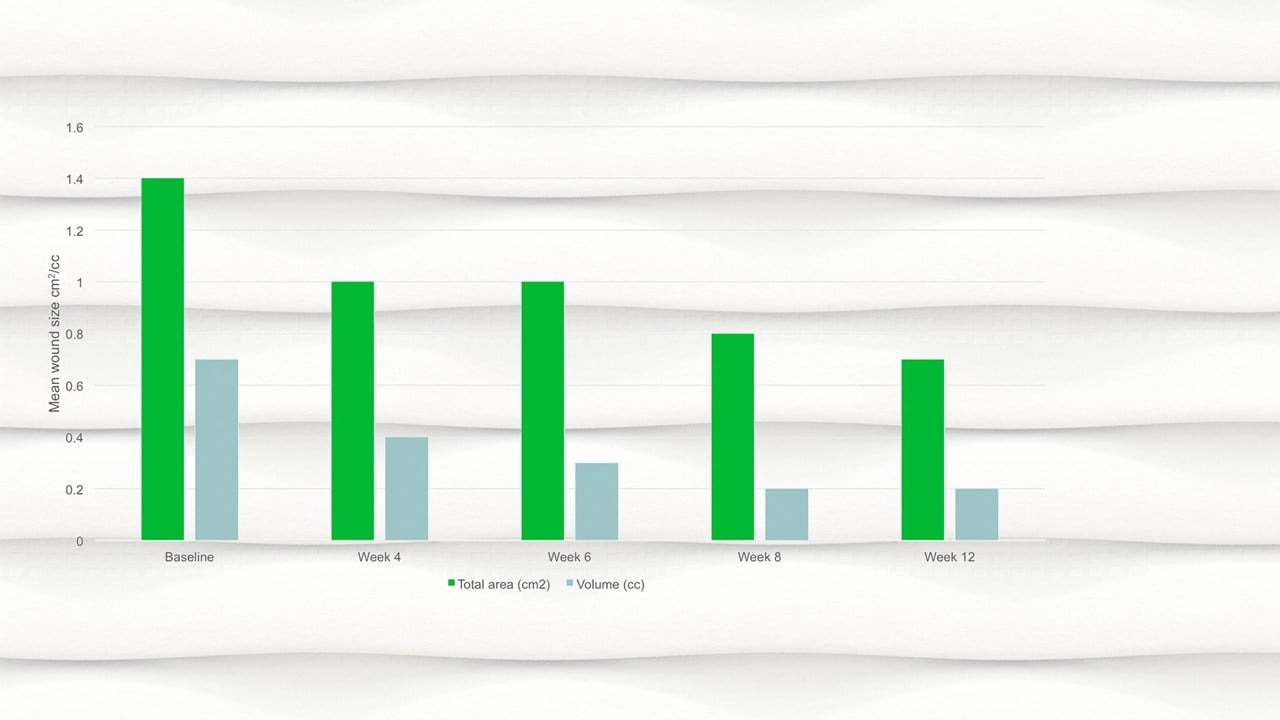
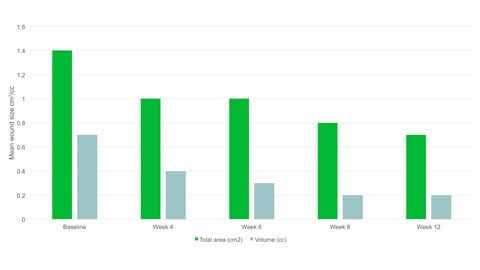
- En semaine 12, la surface moyenne de la plaie avait diminué de moitié par rapport au début de l'étude, avec une surface moyenne de 0,7cm2.
- Une réduction significative de la surface de la plaie, p=.094 et du volume de la plaie, p=.0056 a été observée entre le début de l'étude et la visite finale.
- Une augmentation graduelle du pourcentage moyen du tissu d'épithélialisation et un léger déclin du pourcentage moyen du tissu de granulation ont été observés tout au long de l'étude ; le pourcentage de tissu non viable est resté bas tout au long de l'étude.
- Le nombre de plaies cicatrisées est passé de 1 (4,8%) en semaine 1 à 5 (23,8%) en semaine 12.
Signes cliniques d'infection
Peu de signes cliniques d'infection ont été relevés tout au long de l'étude.
Évaluation de l'investigateur / du personnel infirmier
Le pansement à l'étude a reçu une note élevée en ce qui concerne la facilité d'application, la facilité de retrait, l'absence d'adhérence au lit de la plaie et l'état sain de la peau au retrait, la flexibilité, la conformabilité, la capacité à absorber l'exsudat, la capacité à retenir la nécrose humide et le sang et l'expérience globale.
Évaluation du patient
Le pansement à l'étude a reçu des notes élevées en ce qui concerne l'absence d'anxiété lors du changement de pansement, la facilité de mouvement associée au port du pansement, la capacité du pansement à rester en place, l'absence de picotements ou de brûlures associés au port du pansement et le confort d'utilisation.
Aucun EI / EID jugé comme étant lié au produit étudié n'a été signalé au cours de l'étude.
Conclusions
- Les résultats de cette étude ont démontré la capacité du pansement pour plaies étudié à minimiser les lésions au niveau de la peau périlésionnelle et la douleur associée au pansement.
- Même si la plupart des plaies n'avaient pas cicatrisé à la fin de la période d'étude, des améliorations ont été observées en ce qui concerne le type de tissu et la réduction importante de la surface et du volume de la plaie.
- Les performances techniques du pansement ont été démontrées par sa capacité à absorber et à retenir l'exsudat.
- L'innocuité du produit a été démontrée par une augmentation du nombre de patients présentant une peau périlésionnelle saine / intacte et l'absence d'EI / EID identifiés liés au produit.










